广二医院肿瘤科最新研究成果震撼抗癌界:国产益生菌BF839效果媲美PD-1,联用疗效翻倍!
2025 年 3 月 31 日,广州医科大学附属第二医院科研团队于 SCI 期刊《Frontiers in Microbiology》发表重要研究成果《The therapeutic promise of probiotic Bacteroides fragilis (BF839) in cancer immunotherapy》:揭示我国自主分离的益生菌株——脆弱拟杆菌BF839不仅单独使用效果堪比“抗癌神药” PD-1 抑制剂,更能使其疗效翻倍升级!这项突破性研究,让这株已产品化上市近30年的国产菌株终于在世界抗癌舞台上崭露头角。

肠道菌群成抗癌“隐形战友”
免疫检查点抑制剂(如PD-1/PD-L1抑制剂)是近年来抗癌领域的明星药物,通过唤醒人体自身免疫系统攻击肿瘤。但临床数据显示,只有少部分肿瘤患者对这类"免疫神药"有反应,而且还可能出现耐药情况。对于大多数癌症患者,它没办法阻止病情恶化、解决生命危险。其次,它激活免疫系统杀肿瘤时,容易破坏身体正常组织,引发免疫相关不良事件,如瘙痒、皮疹、恶心、腹泻和甲状腺疾病等[1]。一旦出现这些不良反应,就得停药治疗,影响治疗效果。因此,科学家们将目光投向人体内数以万亿计的肠道菌群,发现这些微观生命体的平衡状态直接影响着抗癌疗效。
在这项研究中,我们了解到“肠道就像人体第二个大脑,其中的有益菌不仅能维护消化健康,还能通过复杂信号与免疫系统对话;而且特定益生菌株可以训练免疫细胞更精准识别肿瘤,相当于为抗癌战士配备'智能导航'。”基于这一理论,研究团队揭示了BF839菌株的三重抗癌实力:
1、单兵作战:效果直追PD-1
在黑色素瘤小鼠实验中,单独口服BF839的肿瘤抑制效果与PD-1抗体治疗几乎持平。更令人振奋的是,两者配合使抗癌效果产生1+1>2的协同效应:联合治疗的肿瘤体积缩小幅度达到单药或单菌治疗的2.5倍。
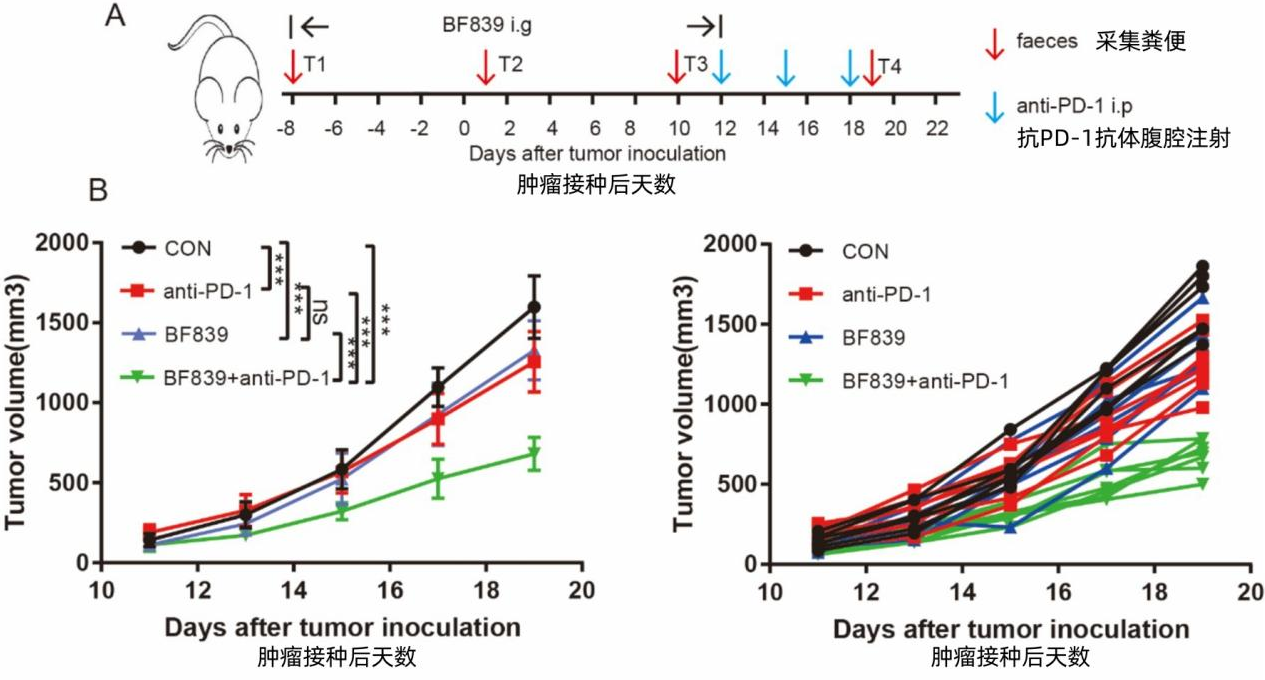
论文 图3. (A) B16黑色素瘤荷瘤小鼠治疗方案示意图。(B) PBS组、BF839组、抗PD-1组及BF839联合抗PD-1组处理的荷瘤小鼠肿瘤体积变化(数据以均值±标准误表示,每组n=7)。
2、黄金拍档:倍增效、破耐药
29例晚期癌症患者的真实世界数据显示,持续服用BF839菌株制剂4个月以上的患者,1年生存率从26.67%跃升至86.15%,2年生存率也实现翻倍。特别是有患者持续用菌后,原本失效的PD-1治疗重新起效,为耐药患者打开生命新通道。
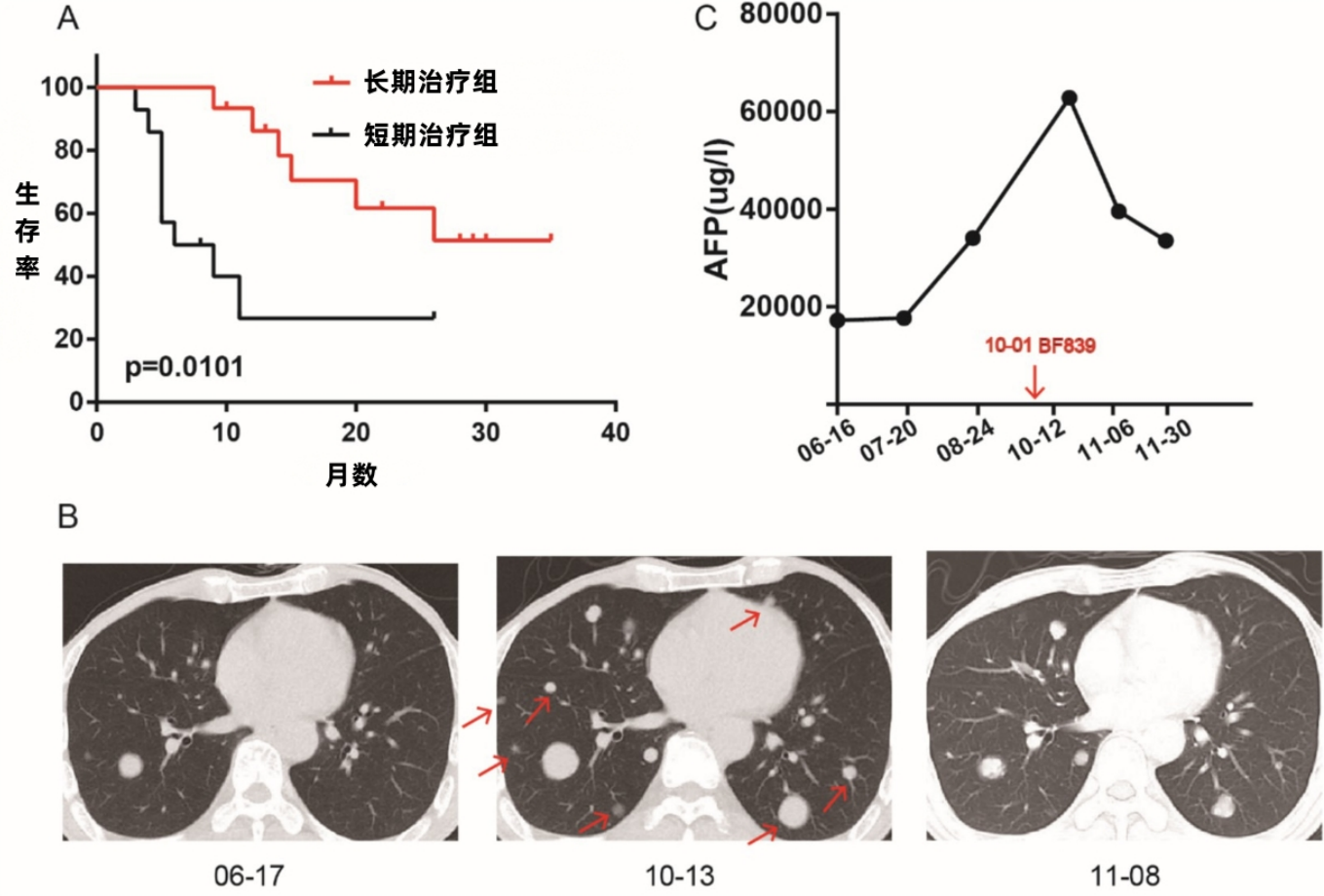
论文 图1. 长期口服BF839可改善接受免疫治疗的患者的生存率。(A) BF839短期治疗组与长期治疗组的生存分析。(B) BF839治疗前后典型肺转移病灶的影像学对比。(C) BF839治疗前后甲胎蛋白(AFP)水平变化。
3、重塑肠道:构建"抗癌生态"
16S测序显示,BF839能够有效增加肠道微生物群落的物种丰富度和均匀度,构建更复杂的菌群网络。这种多样性提升是维持肠道生态稳定的关键指标,与抗肿瘤免疫应答增强密切相关。
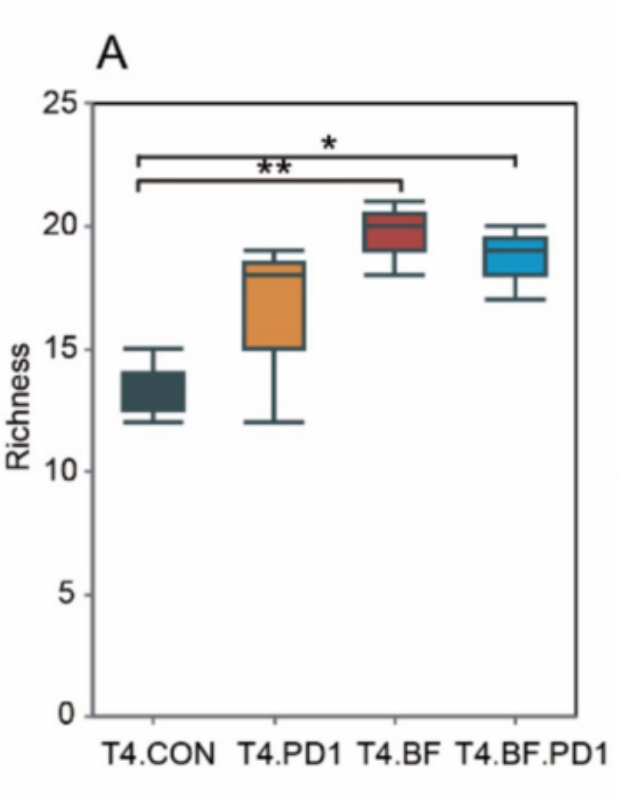
论文 图4(A)属水平肠道菌群α多样性分析,显示BF839组较对照组显著提高菌群丰富度
解密菌株抗癌机制
通过小鼠实验和临床数据分析,研究团队发现了BF839的独特抗癌机制:
1、激活 “抗癌通路”,启动免疫预警
人体中的“胞质 DNA 感受(cGAS - STING)通路”在对抗肿瘤过程中发挥着关键作用。研究显示,BF839 能够激活这一通路,就如同启动了身体内部的 “抗癌警报通路”,肿瘤细胞会释放“求救信号”(干扰素),吸引免疫细胞前来围剿。科学家通过构建特殊的细胞模型,即敲除 B16 - STING 基因(这相当于拆除了 “警报器” 的关键部分),发现 BF839 对肿瘤的生长抑制作用明显减弱,甚至消失。这证实了 BF839 是借助 cGAS - STING 通路来实现其抑制肿瘤生长功效的。
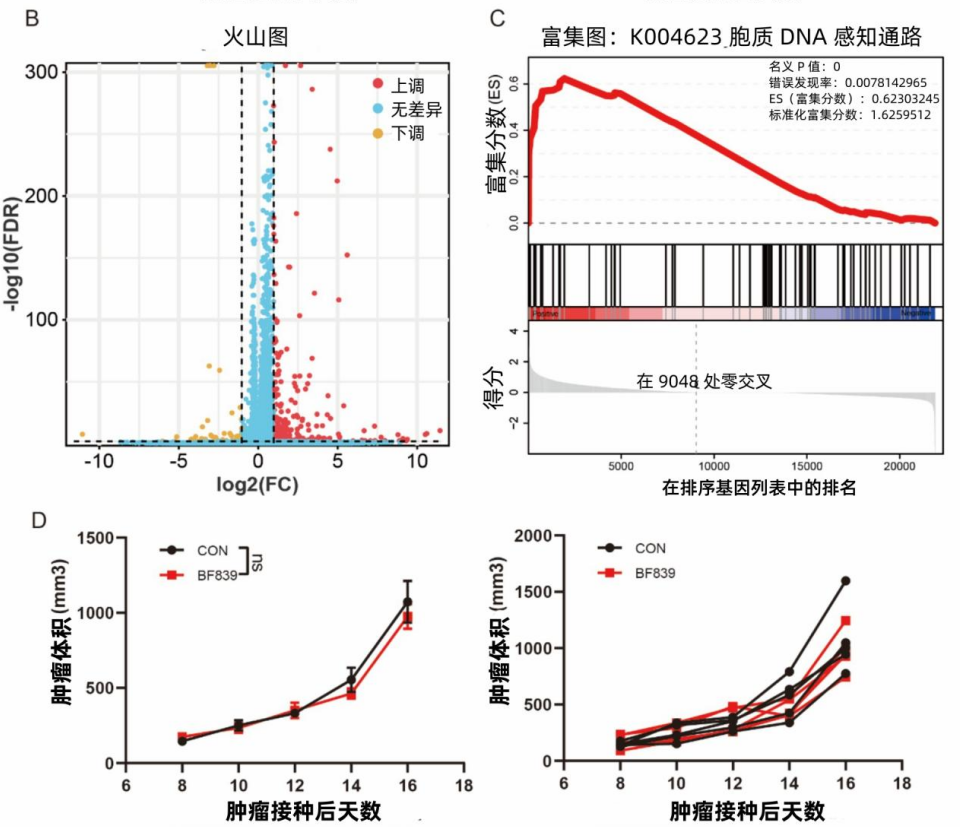
论文 图2. (B)RNA-seq分析鉴定PBS组与BF839组间412个差异表达基因。(C)胞质DNA感受(cGAS-STING)通路的GSEA分析结果。(D)B16-STING-KO荷瘤小鼠经PBS或BF839处理后的肿瘤体积变化(数据以均值±标准误表示,每组n=6)。
2、优化肿瘤微环境,协同免疫治疗
肿瘤微环境就像是肿瘤细胞生长的 “土壤”。研究发现,BF839 能够促进 CD8+T 细胞(一种免疫细胞)在肿瘤微环境中浸润,简单来说,就是让更多具有抗癌能力的 “免疫战士” 聚集到肿瘤周围,增强对肿瘤细胞的攻击力度。当 BF839 与抗 PD - 1 抗体联合使用时,这种效果更加显著。而对于另一种 Foxp3+T 细胞,BF839 对其在肿瘤微环境中的浸润影响并不明显。这充分说明 BF839 与抗 PD - 1 疗法之间存在协同作用,主要是通过增加 CD8+T 细胞在肿瘤微环境中的数量和活性,来提升整体抗癌效果。
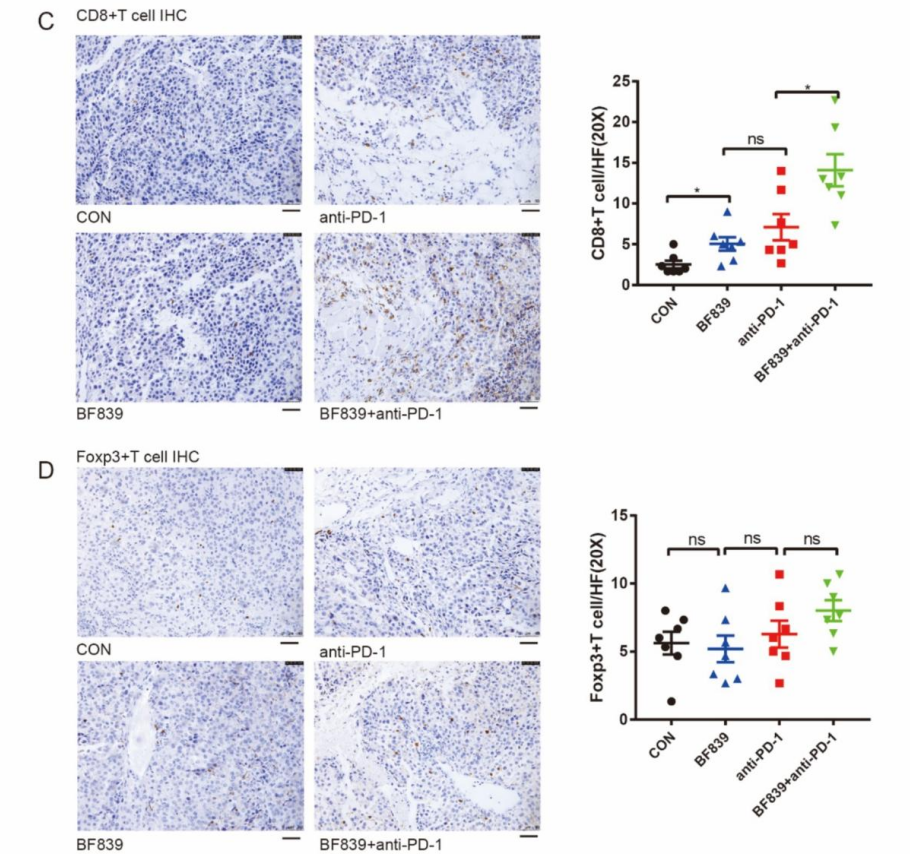
论文 图3. (C) 肿瘤组织CD8+T细胞代表性免疫组化染色及定量分析(数据以均值±标准误表示,每组n=7)。标尺:50μm。(D) 肿瘤组织Foxp3+T细胞代表性免疫组化染色及定量分析(数据以均值±标准误表示,每组n=7)。标尺:50μm。
3、调节肠道菌群,构建免疫后花园
肠道负责 99%营养吸收、90%毒素排泄,是人体 70-80%免疫细胞家园,也寄居着大量的微生物,这些微生物共同构成了肠道菌群,与免疫息息相关。通过专业的 16S rRNA 测序技术分析发现,使用 BF839 后,肠道菌群的多样性得到了有效改善。通俗来讲,就是肠道内有益微生物的种类和数量变得更加丰富,肠道生态环境更加健康。健康的肠道菌群有助于调节人体的免疫系统,增强身体的抵抗力,从而间接地发挥抗癌作用。相比之下,虽然抗 PD - 1 抗体治疗也在一定程度上改善了肠道菌群多样性,但效果不如 BF839 显著。
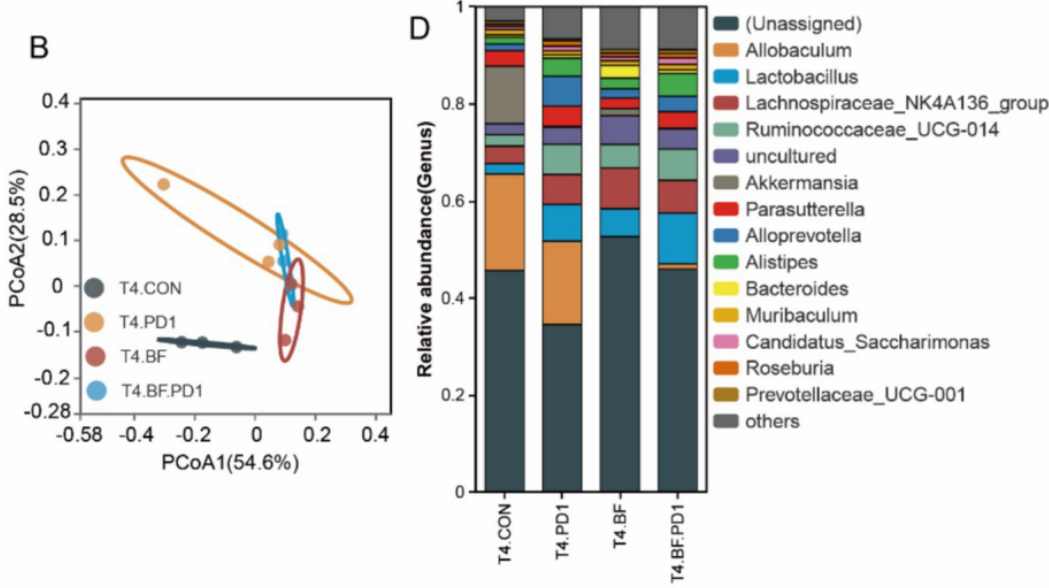
论文 图4(B)基于Bray-Curtis距离的属水平主坐标分析(PCoA)表明BF839组与对照组菌群结构存在显著分离(ANOSIM p<0.05);(D)属水平热图分析显示BF839组Allobaculum(异杆菌属)丰度显著降低(p<0.01)。
这项突破性研究不仅为提升免疫疗法效果提供新思路,更印证了"以菌治癌"这一创新理念的可行性,标志着我国在肿瘤微生态治疗领域迈出重要一步。脆弱拟杆菌BF839是1983年9月从健康婴儿肠道分离的革兰阴性杆菌,不仅安全性高,作为市场和临床已应用多年的益生菌制剂,去年已有研究文献发布[2],证实其辅助治疗可有效降低传统化疗的副作用。本报道论文通过实验证明BF839的抗癌效果具有菌株特异性(如热灭活菌株和双歧杆菌四联活菌无效),其疗效可能无法通过其他益生菌替代。患者切勿自行服用普通益生菌产品替代治疗,应在医生指导下使用经临床验证的特定菌株。
参考文献:
[1]Jiang H, Zhang Q. Gut microbiota influences the efficiency of immune checkpoint inhibitors by modulating the immune system (Review). Oncol Lett. 2024 Jan 5;27(2):87.
[2]Zeng T, Deng YH, Lin CH, Chen XX, Jia HX, Hu XW, Xia T, Ling Y, Zhang LH, Cao TF. A randomized trial of Bacteroides fragilis 839 on preventing chemotherapy-induced myelosuppression and gastrointestinal adverse effects in breast cancer patients. Asia Pac J Clin Nutr. 2024 Mar;33(1):23-32.


