术后食管瘘难愈,营养微生态助力康复!
作者:李钟洋 詹创裕 曾婷
术后并发症
围术期营养支持(Perioperative Nutritional Support),是外科治疗过程中至关重要的一环,涵盖术前、术中和术后整个阶段。研究显示,40%至50%的手术患者存在不同程度的营养不良[1]。这种状况不仅是导致感染率升高、切口愈合不良、压疮发生及住院时间延长等一系列不良临床结局的关键风险因素[2–4],严重影响预后。食管瘘是颈椎前路手术中并发症,死亡率高达19%[5]。当营养不良与食管瘘叠加时,如何在患者术后住院期这一有限的时间窗口内,实施高效的营养干预以稳住生命线,便成为一道棘手的难题。
案例展示
初诊评估
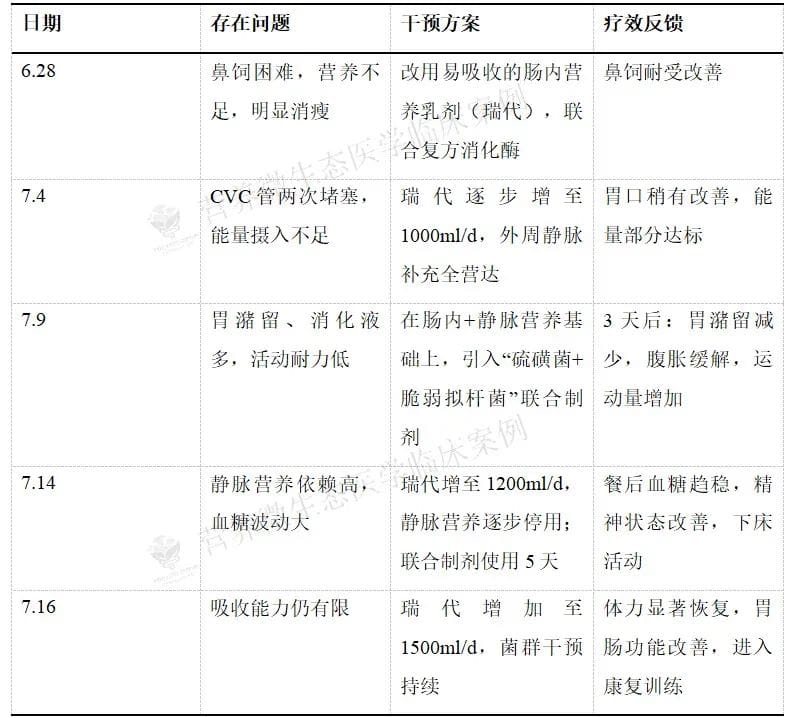
2025年5月,61岁的汪先生(化名)因颈痛伴右上肢麻木入院,于5月16日全麻下接受手术。因其基础状况较差(具多年高血压、糖尿病及冠心病史),术后并发食管瘘、脓气胸及重症肺炎,转入ICU。经过抗感染、胸腔闭式引流、换药及透析治疗后,转出ICU。此后一直住院康复,但住院1.5月,食管瘘口一直未愈合,因此无法经口进食,进行了胃减压引流和肠管喂养,但是胃肠功能难以恢复,肠管喂养每天量不能超过500ml ,否则会腹胀腹痛,也补充了静脉营养,但是静脉导管多次堵塞;体重明显下降,血糖波动大,在持续使用抗生素下,出现伤口、支气管以及胸水的多重耐药菌感染。于6.28请临床营养科会诊。
时间轴干预进展
一波三折
7月21日,患者更换鼻肠管,此后出现不适,每次鼻饲营养液后不适,鼻饲量锐减至500ml/天,并出现便秘,调整鼻肠管位置后无改善。经我科会诊后,改为营养泵辅助鼻饲,改用硫磺菌+更强效的复合益生菌制剂,患者胃肠不适状态明显好转,肠内营养液恢复至1500ml/天,已经停用静脉营养,餐后血糖稳定,大便每天一次,体重回升,能够下床做一些简单活动,并参与一定的康复训练,抗生素于8.8停用,感染无反复。预计患者出院在即。
专业分析
加速康复外科(Enhanced Recovery After Surgery,ERAS)[6]指南明确推荐术后早期肠内营养支持,以缩短术后住院时间;而《欧洲肠外肠内营养学会外科营养指南》[7]亦指出,高营养风险或营养不良的手术患者,应在围术期接受 10–14 天的营养支持,优先选择肠内营养,必要时联合静脉营养。然而,在临床实践中,由于手术应激、出血、抗生素及各种药物的使用,使肠道微生态失衡和胃肠道缺血发生率增加,导致胃肠功能下降,甚至出现胃储留和麻痹性肠梗阻。这个时候,患者出现呕吐,便秘、腹胀、腹痛、对肠内营养不能耐受,既往的常规处理只能以静脉营养维持患者生命需求,但是肠内营养迟迟不能恢复,患者极易出现营养不良和肠源性感染,可以说,此时伤口愈合困难和多重耐药菌感染是必然的现象。正如该例患者前期的表现一样。
我院临床营养科近年来提出了“营养微生态医学”的新概念,对大量疾病尤其是胃肠道疾病有良好的疗效。我们认为,对于术后患者,胃肠道的管理是核心,只有迅速恢复患者的胃肠道功能,让患者能自主进食,才能预防和减少并发症,更快地康复。研究表明,围手术期使用益生菌等微生态制剂可显著降低术后感染并发症的风险[8],其作用机制包括竞争性排斥潜在致病菌和直接的抗菌作用[9],以及对肠屏障和免疫功能的调节,从而迅速恢复胃肠道功能。然而,在危重患者中,普通的益生菌也难以起到如此强大的作用,在本案例中,我们应用了以“硫磺菌+脆弱拟杆菌BF839”为核心的复合强效菌群制剂,收到了良好的效果。该方案不仅促进了胃肠功能的恢复(表现为干预后患者逐渐耐受了肠内营养),也促进了营养的吸收(表现为体重的增加和运动的恢复),更增强了免疫力(多重耐药菌的消失和抗生素停用后的无反弹)。这再一次印证了:胃肠道的管理是术后管理的核心!
参考文献
[1] BRUUN L, BOSAEUS I, BERGSTAD L, et al. Prevalence of malnutrition in surgical patients: evaluation of nutritional support and documentation[J/OL]. Clinical Nutrition, 1999, 18(3): 141-147. DOI:10.1016/S0261-5614(99)80003-X
[2] HO J W C, WU A H W, LEE M W K, et al. Malnutrition risk predicts surgical outcomes in patients undergoing gastrointestinal operations: results of a prospective study[J/OL]. Clinical Nutrition, 2015, 34(4): 679-684. DOI:10.1016/j.clnu.2014.07.012
[3] BURGOS R, JOAQUÍN C, BLAY C, et al. Disease-related malnutrition in hospitalized chronic patients with complex needs[J/OL]. Clinical Nutrition, 2020, 39(5): 1447-1453. DOI:10.1016/j.clnu.2019.06.006
[4] ALI ABDELHAMID Y, CHAPMAN M J, DEANE A M. Peri‐operative nutrition[J/OL]. Anaesthesia, 2016, 71(S1): 9-18. DOI:10.1111/anae.13310
[5] HERSHMAN S H, KUNKLE W A, KELLY M P, et al. Esophageal perforation following anterior cervical spine surgery: case report and review of the literature[J/OL]. Global Spine Journal, 2017, 7(1_suppl): 28S-36S. DOI:10.1177/2192568216687535
[6] MORTENSEN K, NILSSON M, SLIM K, et al. Consensus guidelines for enhanced recovery after gastrectomy[J/OL]. British Journal of Surgery, 2014, 101(10): 1209-1229. DOI:10.1002/bjs.9582
[7] 韦军民. 从欧洲肠外肠内营养学会外科营养指南更新探讨围术期营养支持[J/OL]. 中华消化外科杂志, 2020, 19(10): 1038-1043. DOI:10.3760/cma.j.cn115610-20200824-00579
[8] CHOWDHURY A H, ADIAMAH A, KUSHAIRI A, et al. Perioperative probiotics or synbiotics in adults undergoing elective abdominal surgery: a systematic review and meta-analysis of randomized controlled trials[J/OL]. Annals of Surgery, 2020, 271(6): 1036-1047. DOI:10.1097/SLA.0000000000003581
[9] NG S C, HART A L, KAMM M A, et al. Mechanisms of action of probiotics: recent advances:[J/OL]. Inflammatory Bowel Diseases, 2009, 15(2): 300-310. DOI:10.1002/ibd.20602