74年脆弱拟杆菌研究史,BF839引领二代菌(NGP)临床应用40载!
取之于人、用之于人的肠道菌群
人体肠道菌群,一个隐藏在人体内部的大千世界。
当我们仰望星空,从外太空看地球,很难发现人类的踪迹。其实我们的身体也像一个神秘的小宇宙,里面住着许多“寄居者”——微生物。
就像我们探索大千世界一样,对于身体这个微观世界,还有很多未知等待我们。肠道堪称人体小世界里极具魅力的新大陆,这里汇聚着海量的微生物。这里的微生物数量惊人,种类丰富,人体 99%的微生物种类都能在肠道找到,大多是有益的小伙伴,只有极少数是捣乱的致病菌。
肠道菌群并非与生俱来。胎儿在妈妈的子宫里处于无菌的状态,出生后,随着呼吸、进食,各种“始祖菌”入驻肠道,逐渐形成稳定的肠道菌群。人体约有 40 万亿至 60 万亿个细胞,而肠道微生物则多达 400 万亿至 600 万亿个,约为人体细胞数量的 10 倍;人体基因组大概涵盖 2 万个基因,人体内微生物的基因数量却远超于此,约为人基因的 100 至 500 倍。正因如此,研究者赋予肠道微生物一个生动的称呼:“第二基因组”。
随着研究的深入,人们发现肠道菌群和人类的健康有着千丝万缕的联系,像心血管疾病、代谢性疾病、肥胖、衰老等问题都与其相关。虽然只有少数菌的作用机制已被探明,但改善肠道菌群确实能让许多疾病症状得到缓解,甚至是治愈。
然而,在益生菌的应用中,普通一代益生菌历史悠久,鱼龙混杂,监管部门认可的功能少之又少。一代益生菌功效存疑但挣大钱,二代益生菌规范开发才是未来!
二代益生菌(NGP)指的是具有治疗性的微生物,具备独特且具有开创性的多靶点作用特征。由于其独特的治疗性作用,二代益生菌正在对现有益生菌市场进行洗牌。传统益生菌主要改善胃肠道不适、低免疫力、儿童龋齿以及妇科状况等。而二代益生菌当下已经在针对性改善神经系统疾病、肿瘤、高血脂、高血糖、肥胖、精神压力等诸多方面展现出令人惊叹的效果,不断积累益生菌干预的安全性数据,并在培养更健康的生活方式上持续彰显出非凡的潜力。微生物组研究工具的创新和理论的积累,也将为二代益生菌的转化临床应用筑牢坚实的基础。
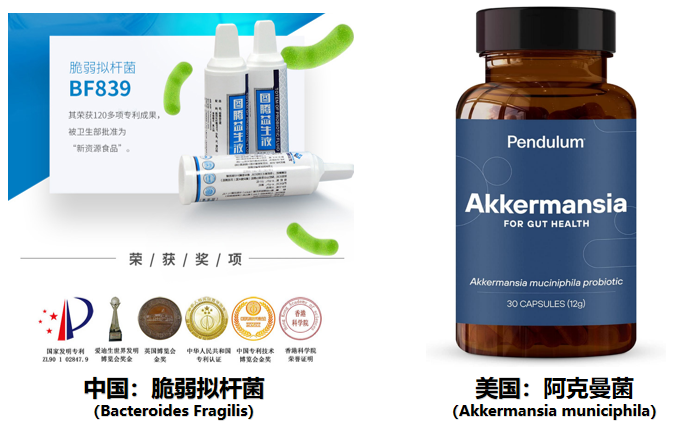
图腾生命作为中国领先的微生态制剂及合成生物技术原研企业,在肠道微生物研发及临床应用领域深耕四十余载,拥有全球最早的二代益生菌(NGP)产品——图腾益生口服液(脆弱拟杆菌 BF839)。
从二代益生菌探索脆弱拟杆菌的地位
二代益生菌(Next-Generation Probiotics)在国际上简称为 NGP,其定义为旨在预防、治疗或治愈疾病的生物产品。它和普通益生菌又有啥不一样呢?普通益生菌主要是在达到一定量服用后,能对人体健康产生有益影响,更多的是对健康进行干预。而二代益生菌则专注于治疗疾病,这就是它们的关键区别。
2017年,世界权威学术期刊Nature子刊《nature microbiology》,发布了重磅文章《Next-generation probiotics: the spectrum from probiotics to live biotherapeutics》,意指“二代益生菌 Next-generation probiotics”的时代已经徐徐开启,大有可为”,并探索了现有已知可能被用作新型微生物疗法的生物种类,其中脆弱拟杆菌、阿克曼菌、普氏粪杆菌、霍氏真杆菌、罗斯氏菌等备受关注。在这五种菌株里,脆弱拟杆菌和阿克曼菌更是被深度研究,并且已经产品化上市,也是目前全世界唯二产品化上市的二代益生菌。
在微生物的奇妙世界里,脆弱拟杆菌(Bacteroides fragilis)可是拟杆菌属的重要角色。它是一种革兰氏阴性、不形成孢子、杆状的专性厌氧菌,广泛存在于人类的肠道菌群中,同时也是人类健康中不可或缺的角色。
一开始,人们关注到它,是因为它的“兄弟”导致了疾病的出现。1950 年,关于脆弱拟杆菌的研究文献首次发表,随后的很长一段时间里,大部分研究都集中在它不好的一面。
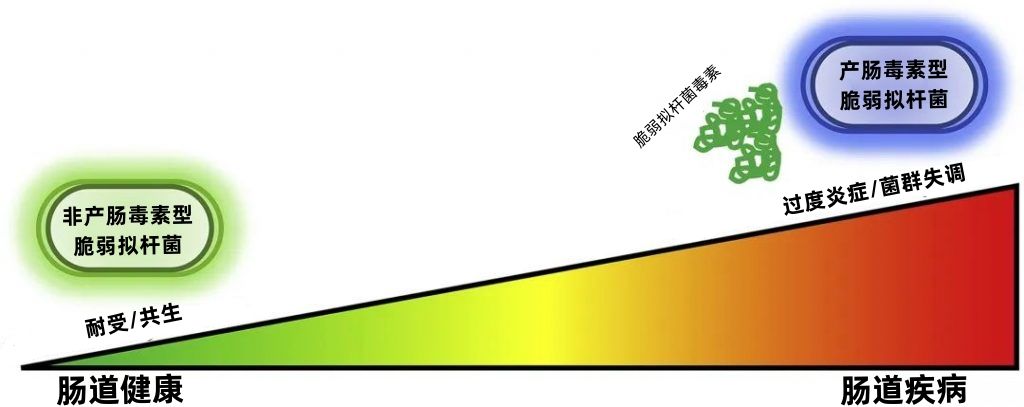
其实,脆弱拟杆菌是有两种,一种是产毒型的在人体内的脆弱拟杆菌里占到20%左右,正常健康人体不会表现出来,是无症状的,另外一种,也就是我们现在临床上用的这种是非产毒型的脆弱拟杆菌,在脆弱拟杆菌里占80%左右,为人体的生命活动、维持健康、干预疾病、塑造免疫系统等起着重要且无可替代的作用。当产毒型脆弱拟杆菌占据上风的时候,这一平衡被打破,这个“恶毒的兄弟”就会肆意破坏肠道环境,甚至通过受损的肠道黏膜逃窜到体内的各组织和器官搞事情,引发感染。恢复和维持平衡最好的办法,就是补充“好兄弟”--非产毒型脆弱拟杆菌。
在脆弱拟杆菌的74年研究历史中,由于它的“兄弟”-产毒型脆弱拟杆菌做的坏事而被科学家们误解、蒙受冤屈长达25年。直到 1975 年,哈佛医学院的 Karsper 教授为它带来了“转机”。教授发现脆弱拟杆菌其实是人体的共生菌,其荚膜具有免疫学特性,从此开启了漫长的研究之旅。就在同一年,还有科学家惊喜地发现非产毒型的脆弱拟杆菌能产生对人体健康和疾病干预极其重要的短链脂肪酸。而且,这一年大家还知道了维生素 K 居然也依赖共生菌才能在人体内合成。
Karsper 教授没有停下脚步,第二年便发现产生免疫学特性的是荚膜多糖 A 的结构。可这还不够,教授潜心钻研,经过几十年的努力,终于在 2002 年搞清楚了脆弱拟杆菌的免疫机制——MHCII通路机制(启动和调节适应性免疫反应的关键生理通路)。以Kasper教授作为主编之一的权威医学教科书《哈里森内科学》中关于人体微生物组的章节,也详细阐述了脆弱拟杆菌独特的免疫调节抗炎、抗肿瘤分子机制,以及代谢胆盐、产生短链脂肪酸和为其他共生菌提供营养的能力。 到目前为止,脆弱拟杆菌拥有超过1000篇的研究文章,备受国际科学家的认可。不过,国外对于脆弱拟杆菌及其 PSA 的研究大多集中在机制通路上,临床应用几乎没有。

BF839引领二代菌(NGP)临床应用40载
在中国,1983 年 9 月,一个不一样的故事开始了。图腾益生创始人、大连微生物研究所的张季阶教授在健康婴儿的体内发现了脆弱拟杆菌。他从婴儿的粪便中提取出菌株,经检测和鉴定为无毒、无遗传毒性的脆弱拟杆菌,并命名为脆弱拟杆菌BF839,经培育后亲自试用。神奇的事情发生了,他的身体状况和疾病都有了明显的改善。于是,张教授开始让身边的人试用,并进行大样本的临床观察实验。结果令人欣喜,脆弱拟杆菌对人体的免疫、生长发育以及各种炎性疾病、免疫相关疾病都有着显著的有益效果。脆弱拟杆菌BF839于1990年8月2日获得中国微生物菌种保藏管理委员会普通微生物中心永久收藏保存;1995年,在《中国生物制品学杂志》发表第一篇临床研究论文《脆弱拟杆菌(BF839)菌液的临床应用研究》,于1997年经国家卫生部门的专家审评,获得新资源食品批文,成为国内首个研发上市的二代益生菌,实现规模化生产,填补了国内外的空白,为中国微生物事业带来了划时代的意义。

然而即便如此,产毒型脆弱拟杆菌塑造的形象仍深深影响至今,提到脆弱拟杆菌,人们的认知里还是那个坏兄弟的形象,也在一定程度上阻碍了有着惊艳临床效果的好兄弟的“前途”。
至2018 年,广州图腾生命也加入进来,联合医疗机构开展了一系列临床研究和科研实验,为 BF839 的临床应用提供了强有力的科研依据和支撑:
从2021年开始,广州医科大学附属第二医院的邓宇虹主任医师研究团队将脆弱拟杆菌BF839在难治性癫痫、自身免疫性癫痫、银屑病、自闭症、帕金森、阿尔茨海默症、肿瘤、艾滋病等方面的临床研究和科研实验均做了深入探讨,且取得了喜人的成果,其中部分研究成果已在相关领域的专业杂志上发表。这些成果引起了国内医生们的关注;
2022年5月,深圳儿童医院癫痫中心的操德智主任和陈鸿医生完成了二代益生菌脆弱拟杆菌BF839应用于儿童难治性癫痫的随机双盲临床研究;
2023年3月,上海交大医学院刘尽尧教授研究团队的脆弱拟杆菌BF839 改善结肠炎研究,登上Science子刊;
2023年7月,国内顶级的华西医院神经内科洪桢教授团队启动了《二代益生菌 (脆弱拟杆菌BF839和鼠李糖乳杆菌TT-628)添加治疗癫痫的有效性及耐受分析》的全国多中心随机对照研究。
2024年3月,《Asia Pac J Clin Nutr》发表全球首个在单菌(脆弱拟杆菌BF839)辅助治疗癌症方面取得阳性结果的随机对照实验。
......
随着临床研究的展开,越来越多的医生对二代益生菌通过肠屏障改善健康与疾病的新治疗策略的了解和应用,将会有越来越多患者受益。
这就是中国和国外在脆弱拟杆菌研究上的不同。我们更愿意让这个好东西走出实验室,真正造福人类!
脆弱拟杆菌在肠道“安身立命”的秘密[1]是通过其基因中独有的共生定居因子(commensal colonization factors, CCF),使其比其他细菌有更强的定植肠上皮的能力。原本作为厌氧菌的脆弱拟杆菌经图腾生命独家专利技术已经培养为兼氧菌BF839,即有氧无氧环境均可存活,更进一步提升其强大的肠道定植能力。脆弱拟杆菌BF839作为兼氧菌的不规则形态二代益生菌和普通菌种的生产工艺有很大不同。普通菌种只有1-2种培养基就能存活,而BF839是有二十几种培养基,同时采用德国最先进技术四层包埋技术,保证达到最佳效果,BF839的菌种特性和生产工艺决定了它的良好治疗效果。
脆弱拟杆菌的研究与应用
迄今为止,脆弱拟杆菌(Bacteroides fragilis)菌株已被证明可以抑制不同器官的炎症,包括腹膜、肠道、大脑和肺。这个菌株还可以抑制病原菌感染并支持癌症治疗。
脆弱拟杆菌的PSA(两性离子结构)、PSA脂多糖、糖鞘脂(GSL)、代谢物(如短链脂肪酸、γ-氨基丁酸、α-半乳糖基鞘氨醇、谷氨酸、吲哚-3-乙酸)、衍生物(如3-苯基丙酸)等协同发挥作用通过调节免疫、抗炎、修复肠道黏膜、恢复肠道菌群平衡等方面发挥作用,从而干预各类疾病。其中,荚膜多糖A(PSA)被确定为脆弱拟杆菌产生免疫调节作用的主要功能分子。这种多糖具有由重复寡糖单元组成的两性离子结构,该重复寡糖单元包含具有游离氨基和羧基的组成糖,并且对于菌株的有利生物活性至关重要。[2]
图腾生命医学研究院-独家编辑-脆弱拟杆菌生理机制链路图全览
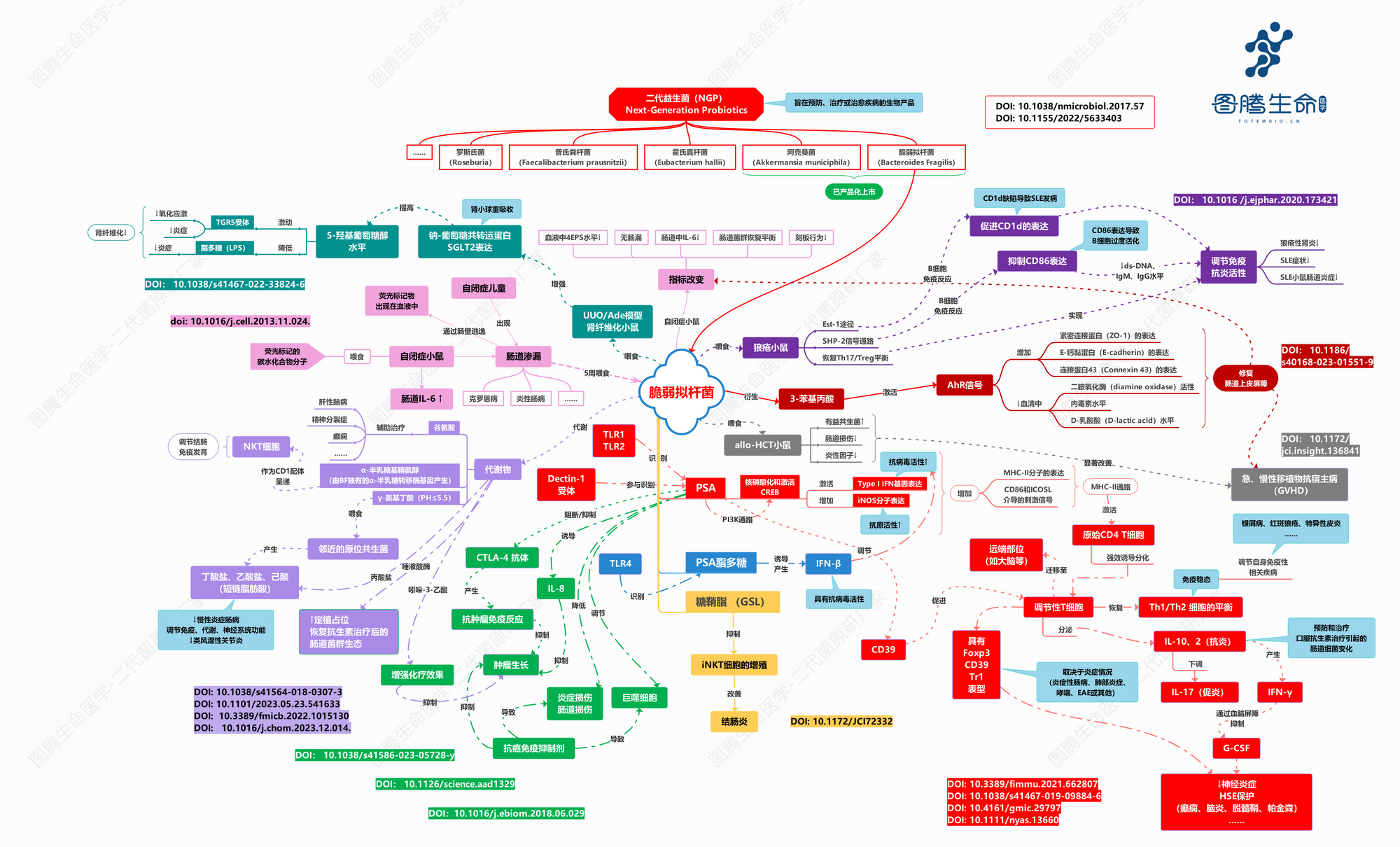
--脆弱拟杆菌与宿主健康的关系:
刺激、发育和免疫系统的稳态
2005年发表在国际顶尖学术期刊《Cell》杂志上的一篇研究论文表明:脆弱拟杆菌PSA是指导宿主免疫系统发育的模范共生因子。与无菌动物的比较表明,在脆弱拟杆菌定植期间,PSA 的免疫调节活性包括纠正全身性 T 细胞缺陷和 T(H)1/T(H)2 失衡以及引导淋巴器官生成。脆弱拟杆菌的 PSA 突变体不能恢复这些免疫功能。由肠道树突状细胞呈递的 PSA 激活 CD4 + T 细胞并引发适当的细胞因子产生。[3]
对全身炎症的抗炎作用
脆弱拟杆菌作为国际公认的二代益生菌之一,已被证实能够缓解炎症相关疾病。研究使用脂多糖(LPS)诱导的小鼠全身性炎症模型作为体内模型,观察脆弱拟杆菌菌株对全身性炎症的抗炎作用。研究表明脆弱拟杆菌对小鼠 LPS 诱导的全身性炎症的抗炎作用可能归因于其诱导短链脂肪酸(SCFA )和抗炎因子 IL - 10 的能力。[4]
预防细菌和病毒感染
2020年11月18日,同样是在国际顶尖学术期刊 Cell 杂志上由哈佛医学院的研究人员发表题为: Commensal Microbiota Modulation of Natural Resistance to Virus Infection 的研究论文。这项研究首次在小鼠模型上描述了 肠道细菌是如何帮助抵御病毒感染的 。脆弱拟杆菌 (Bacteroides fragilis)可以有效地启动免疫保护信号级联,诱导结肠中的免疫细胞释放干扰素-β (IFN-β) ,通过干扰病毒RNA或DNA复制而抑制病毒生长,同时还能刺激免疫细胞并增强其杀伤力,诱导感染病毒的细胞的自我毁灭。这种分子或将成为增强人类抗病毒免疫的药物的基础。[5]
另一项研究表明,根据T6SS竞争机制,共生非产毒型可以限制致病性的产毒型脆弱拟杆菌定植并预防结肠炎。BSAP-1是影响微生物群菌株水平组成的重要竞争因子。因此,我们推测脆弱拟杆菌在种间竞争中既使用了已知的竞争机制,也可能与病原体竞争。[6]
2024年底,Nature子刊《nature communications》发布的最新研究成果强力验证了以上推测:肠道共生菌脆弱拟杆菌可分泌抗菌泛素同源物(BfUbb),促进种内细菌竞争,在小鼠肠道中特异性有效消除产肠毒素脆弱拟杆菌(ETBF),提示其治疗 ETBF 相关炎症性肠病和结直肠癌的潜在应用。[7]
通过产生短链脂肪酸维持稳态
不同拟杆菌分泌的代谢物有助于维持免疫系统的稳定。这些物种是人体肠道中短链脂肪酸的主要产生者,主要以乙酸和丙酸的形式存在,对维持肠道内稳态很重要。[8]
乙酸盐和丙酸盐都是有效的抗炎介质,因为它们抑制中性粒细胞和巨噬细胞释放促炎细胞因子。
丙酸盐诱导人结肠癌细胞凋亡的抗癌作用。
丁酸盐增加肠道紧密连接蛋白的表达,以降低潜在的肠道通透性。这反过来又减少了与肠道渗漏相关的炎症和内毒素血症。
通过合成维生素K防治骨质疏松和出血性疾病
维生素 K 参与凝血因子合成,对维持正常凝血功能、防止出血以及通过增加骨矿物质密度防治骨质疏松症具有重要作用。医学上的维生素 K 主要分为三种:维生素 K₁(叶绿醌)、维生素 K₂(甲萘醌类)和维生素 K₃(亚硫酸氢钠甲萘醌)。维生素 K₁存在于绿色植物,主要于小肠上部吸收,需胆汁和胰液参与,生物利用度较低。维生素 K₂由肠道细菌合成,半衰期长,作用持久。维生素 K₃为人工合成的水溶性维生素,吸收较快,但生物利用度不如前两者稳定。与维生素 K₁和 K₂相比,维生素 K₃临床应用有局限性,长期或大剂量使用可能引发不良反应,前两者正常剂量下相对更安全。
在人类肠道中,脆弱拟杆菌是维生素 K₂的主要产生菌之一,补充脆弱拟杆菌可有效合成维生素 K,防治骨质疏松和出血性疾病。[9-10]
与神经发育相关
在研究中,脆弱拟杆菌是所有儿童中第4大丰富的物种,其相对丰度在健康儿童中更高(健康儿童平均相对丰度为0.0748,而中度急性营养不良(MAM)儿童为0.0487),它可能通过参与发酵途径,影响肠道代谢产物的生成,进而对宿主的神经发育和认知功能产生积极影响。[11]
在由 405 名婴儿组成的普通人群出生队列研究中,1 岁时肠道微生物群富含拟杆菌的婴儿,2 岁时 BSID-III 认知和语言发育更优。具有拟杆菌属优势微生物组成的婴儿,认知和语言发育得分分别高出 4.8 分和 4.2 分,接近一半的标准差差异。更重要的是,男婴拟杆菌群在 1 至 2 岁之间 BSID-III 认知和语言评分的变化具有更显著性的差异,男孩语言得分高出 7.9 分。该研究为神经发育结果由婴儿肠道微生物组成以性别依赖性方式塑造这一观点提供了更多证据。
有研究发现,肠道菌群中拟杆菌的消耗是 2 - 3 岁时被诊断患自闭症谱系障碍儿童的特征。在无菌小鼠模型中,肠道微生物群缺失会致认知、记忆及社会发展改变,这是自闭症的核心缺陷。拟杆菌属可能在婴儿晚期关键时期促进神经发育,此时期通常发生髓鞘形成和神经元网络扩展连接,若这些过程减缓,会导致发育迟缓。而拟杆菌属富集多种代谢功能,包括:鞘脂、鞘糖脂生物、叶酸、生物素、丙酮酸、维生素B6、硫辛酸和脂肪酸生物合成代谢。在自闭症小鼠模型显示,脆弱拟杆菌在改善交流和感觉运动行为缺陷方面有潜在作用,可能通过对血清代谢物(包括鞘脂)的调节实现。[12]
与生殖衰老相关
肠道微生物群在生殖发育中起着关键作用。有研究证明。肠道微生物脆弱拟杆菌(BF)移植可通过肠道-卵巢轴运输细胞外囊泡(EVs)来改善卵巢衰老。具体来说,miR-1246通过靶向E3连接酶SKP2,减少了p62的泛素化,稳定了p62的蛋白水平。然后,Keap1-Nrf2 复合物解离,Keap1 被招募形成 p62-Keap1 复合物。随着 Keap1-Nrf2 复合物的解离,Nrf2 被释放和激活,从而促进抗氧化酶的转录,缓解生殖衰老。总之,这些数据表明,肠道细胞衍生的EV是肠道与卵巢之间串联的天然信息载体,肠道微生物移植是治疗卵巢功能障碍疾病的一种很有前景的方法。[13]
与抑郁症相关
有研究表明,缺乏脆弱拟杆菌与抑郁症存在明显联系。脆弱拟杆菌在 GABA 的产生中起重要作用,GABA 即γ-氨基丁酸,是一种抑制性神经递质,大脑中超三分之一突触使用它,对大脑功能至关重要。当神经元过度兴奋破坏时会导致内部系统紊乱,引发抑郁,而 GABA 能对兴奋神经元产生镇静作用。在肠道-大脑连接研究中,科学家发现 GABA 依赖脆弱拟杆菌实现最大生产水平。Evtepia gabavorous 是只吃 GABA 的细菌,若没有脆弱拟杆菌生产 GABA,其会被吃光,导致体内缺乏 GABA,进而出现焦虑、忧郁、不安等情绪。[14]
维持肠道生态系统结构
胃肠道的早期微生物定植对发育和健康有长期影响,拟杆菌属等关键物种在早期生命中突出,对维持肠道生态系统结构起关键作用。研究表明,脆弱拟杆菌中的唾液酸酶 NanH 介导生命早期肠道黏膜稳定占据,调节共生定植程序,该程序由唾液酸化聚糖触发,包括人乳寡糖和肠黏液中的。NanH 是母体向后代垂直传播必需的,促进其早期优势,还有助于明确微生物群落抗生素治疗后的共生恢复和弹性。研究揭示了宿主和微生物群通过宿主衍生聚糖介导的共同进化机制促进稳定定植。[15]
脆弱拟杆菌表现出bsh基因和酶活性,通过抑制FXR-NLRP3信号通路,恢复肠道微生物群落失调和胆汁酸代谢异常,从而减轻肠道损伤。[16]
脆弱拟杆菌的治疗功能特性引发了国内外研究的热潮,许多知名科学家前赴后继开展各项研究,揭示了脆弱拟杆菌以及相关PSA应用在不同疾病中机制研究及临床成果:

图腾生命脆弱拟杆菌BF839系列产品
参考文献:
[1]Lee SM, Donaldson GP, Mikulski Z, Boyajian S, Ley K, Mazmanian SK. Bacterial colonization factors control specificity and stability of the gut microbiota. Nature. 2013 Sep 19;501(7467):426-9. doi: 10.1038/nature12447. Epub 2013 Aug 18. PMID: 23955152; PMCID: PMC3893107.
[2]Tzianabos AO, Finberg RW, Wang Y, Chan M, Onderdonk AB, Jennings HJ, Kasper DL. T cells activated by zwitterionic molecules prevent abscesses induced by pathogenic bacteria. J Biol Chem. 2000 Mar 10;275(10):6733-40. doi: 10.1074/jbc.275.10.6733. PMID: 10702228.
[3]Mazmanian SK, Liu CH, Tzianabos AO, Kasper DL. An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system. Cell. 2005 Jul 15;122(1):107-18. doi: 10.1016/j.cell.2005.05.007. PMID: 16009137.
[4]Qu D, Sun F, Feng S, Yu L, Tian F, Zhang H, Chen W, Zhai Q. Protective effects of Bacteroides fragilis against lipopolysaccharide-induced systemic inflammation and their potential functional genes. Food Funct. 2022 Jan 24;13(2):1015-1025. doi: 10.1039/d1fo03073f. PMID: 35015021.
[5]Stefan KL, Kim MV, Iwasaki A, Kasper DL. Commensal Microbiota Modulation of Natural Resistance to Virus Infection. Cell. 2020 Nov 25;183(5):1312-1324.e10. doi: 10.1016/j.cell.2020.10.047. Epub 2020 Nov 18. PMID: 33212011; PMCID: PMC7799371.
[6]Robitaille S, Simmons EL, Verster AJ, McClure EA, Royce DB, Trus E, Swartz K, Schultz D, Nadell CD, Ross BD. Community composition and the environment modulate the population dynamics of type VI secretion in human gut bacteria. Nat Ecol Evol. 2023 Dec;7(12):2092-2107. doi: 10.1038/s41559-023-02230-6. Epub 2023 Oct 26. PMID: 37884689; PMCID: PMC11099977.
[7]Tong M, Xu J, Li W, et al. A highly conserved SusCD transporter determines the import and species-specific antagonism of Bacteroides ubiquitin homologues. Nat Commun. 2024;15(1):8794. Published 2024 Oct 10.
[8]D'Argenio G, Mazzacca G. Short-chain fatty acid in the human colon. Relation to inflammatory bowel diseases and colon cancer. Adv Exp Med Biol. 1999;472:149-58. doi: 10.1007/978-1-4757-3230-6_13. PMID: 10736623.
[9]Walther B, Karl JP, Booth SL, Boyaval P. Menaquinones, bacteria, and the food supply: the relevance of dairy and fermented food products to vitamin K requirements. Adv Nutr. 2013;4:463–473. doi: 10.3945/an.113.003855.
[10]Singh M. Vitamin K during infancy: current status and recommendations. Indian Pediatr. 1997 Aug;34(8):708-12. PMID: 9492399.
[11]Portlock T, Shama T, Kakon SH, et al. Interconnected pathways link faecal microbiota plasma lipids and brain activity to childhood malnutrition related cognition. Nat Commun. 2025;16(1):473. Published 2025 Jan 8.
[12]Sukhpreet K. Tamana, Hein M. Tun, Theodore Konya, Radha S. Chari, Catherine J. Field, David S. Guttman, Allan B. Becker, Theo J. Moraes, Stuart E. Turvey, Padmaja Subbarao, Malcolm R. Sears, Jacqueline Pei, James A. Scott, Piush J. Mandhane & Anita L. Kozyrskyj (2021) Bacteroides-dominant gut microbiome of late infancy is associated with enhanced neurodevelopment, Gut Microbes, 13:1
[13]Xiong Y, Lu X, Li B, et al. Bacteroides Fragilis Transplantation Reverses Reproductive Senescence by Transporting Extracellular Vesicles Through the Gut-Ovary Axis. Adv Sci (Weinh). Published online January 13, 2025.
[14]Strandwitz P, Kim KH, Terekhova D, Liu JK, Sharma A, Levering J, McDonald D, Dietrich D, Ramadhar TR, Lekbua A, Mroue N, Liston C, Stewart EJ, Dubin MJ, Zengler K, Knight R, Gilbert JA, Clardy J, Lewis K. GABA-modulating bacteria of the human gut microbiota. Nat Microbiol. 2019 Mar;4(3):396-403. doi: 10.1038/s41564-018-0307-3. Epub 2018 Dec 10. PMID: 30531975; PMCID: PMC6384127.
[15]Buzun E, Hsu CY, Sejane K, Oles RE, Vasquez Ayala A, Loomis LR, Zhao J, Rossitto LA, McGrosso DM, Gonzalez DJ, Bode L, Chu H. A bacterial sialidase mediates early-life colonization by a pioneering gut commensal. Cell Host Microbe. 2024 Feb 14;32(2):181-190.e9. doi: 10.1016/j.chom.2023.12.014. Epub 2024 Jan 15. PMID: 38228143; PMCID: PMC10922750.
[16]Chen Z, et al. Bacteroides fragilis alleviates necrotizing enterocolitis through restoring bile acid metabolism balance using bile salt hydrolase and inhibiting FXR-NLRP3 signaling pathway. Gut Microbes. 2024 Jan-Dec;16(1):2379566.
[17]Wang Y, Telesford KM, Ochoa-Repáraz J, Haque-Begum S, Christy M, Kasper EJ, Wang L, Wu Y, Robson SC, Kasper DL, Kasper LH. An intestinal commensal symbiosis factor controls neuroinflammation via TLR2-mediated CD39 signalling. Nat Commun. 2014 Jul 21;5:4432. doi: 10.1038/ncomms5432. PMID: 25043484; PMCID: PMC4118494.
[18]Ramakrishna C, Kujawski M, Chu H, Li L, Mazmanian SK, Cantin EM. Bacteroides fragilis polysaccharide A induces IL-10 secreting B and T cells that prevent viral encephalitis. Nat Commun. 2019 May 14;10(1):2153. doi: 10.1038/s41467-019-09884-6. PMID: 31089128; PMCID: PMC6517419.
[19]邓宇虹,林楚慧,操德智.脆弱拟杆菌(BF839)辅助治疗难治性癫痫有效性的初步临床研究[J].癫痫杂志,2021,7(04):288-295.
[20]陈鸿.脆弱拟杆菌BF839辅助治疗儿童药物难治性癫痫的随机双盲对照临床研究[D].汕头大学,2022.
[21]Bi M, Liu C, Wang Y, Liu SJ. Therapeutic Prospect of New Probiotics in Neurodegenerative Diseases. Microorganisms. 2023 Jun 8;11(6):1527.
[22]Zeng T, Lin C, Deng Y, Zhu W. Effect of BF839 + earthworm protein supplement on motor and some non-motor symptoms of Parkinson's disease: a randomized clinical trial. Front Neurol. 2024 Sep 6;15:1371791.
[23]Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, Codelli JA, Chow J, Reisman SE, Petrosino JF, Patterson PH, Mazmanian SK. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell. 2013 Dec 19;155(7):1451-63. doi: 10.1016/j.cell.2013.11.024. Epub 2013 Dec 5. PMID: 24315484; PMCID: PMC3897394.
[24]林楚慧,曾婷,陆翠薇,等.脆弱拟杆菌BF839治疗儿童孤独症谱系障碍的有效性、安全性研究:一项随机、双盲、安慰剂对照的临床试验[C]//中国营养学会益生菌益生元与健康分会.第五届益生菌益生元科学大会论文集.
[25]林楚慧,曾婷,林键泓,等. 脆弱拟杆菌BF839可改善 Fmr1 KO小鼠的学习记忆能力及社交新奇偏好能力 [J]. 中华神经医学杂志,2022,21(4):341-347. DOI:10.3760/cma.j.cn115354-20211220-00835.
[26]曾婷,林楚慧,邓宇虹,等. 脆弱拟杆菌BF839可改善 Fmr1 KO小鼠在不同环境下的焦虑和多动行为 [J]. 中华生物医学工程杂志,2023,29(4):404-409.
[27]Zeng T, Deng YH, Lin CH, Chen XX, Jia HX, Hu XW, Xia T, Ling Y, Zhang LH, Cao TF. A randomized trial of Bacteroides fragilis 839 on preventing chemotherapy-induced myelosuppression and gastrointestinal adverse effects in breast cancer patients. Asia Pac J Clin Nutr. 2024 Mar;33(1):23-32. doi: 10.6133/apjcn.202403_33(1).0003. PMID: 38494684; PMCID: PMC11170005.
[28]Tintelnot J, Xu Y, Lesker TR, Schönlein M, Konczalla L, Giannou AD, Pelczar P, Kylies D, Puelles VG, Bielecka AA, Peschka M, Cortesi F, Riecken K, Jung M, Amend L, Bröring TS, Trajkovic-Arsic M, Siveke JT, Renné T, Zhang D, Boeck S, Strowig T, Uzunoglu FG, Güngör C, Stein A, Izbicki JR, Bokemeyer C, Sinn M, Kimmelman AC, Huber S, Gagliani N. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer. Nature. 2023 Mar;615(7950):168-174. doi: 10.1038/s41586-023-05728-y. Epub 2023 Feb 22. PMID: 36813961; PMCID: PMC9977685.
[29]Sittipo P, Lobionda S, Choi K, Sari IN, Kwon HY, Lee YK. Toll-Like Receptor 2-Mediated Suppression of Colorectal Cancer Pathogenesis by Polysaccharide A From Bacteroides fragilis. Front Microbiol. 2018 Jul 17;9:1588. doi: 10.3389/fmicb.2018.01588. PMID: 30065713; PMCID: PMC6056687.
[30]Zhou B, Xia X, Wang P, Chen S, Yu C, Huang R, Zhang R, Wang Y, Lu L, Yuan F, Tian Y, Fan Y, Zhang X, Shu Y, Zhang S, Bai D, Wu L, Xu H, Yang L. Induction and Amelioration of Methotrexate-Induced Gastrointestinal Toxicity are Related to Immune Response and Gut Microbiota. EBioMedicine. 2018 Jul;33:122-133. doi: 10.1016/j.ebiom.2018.06.029. Epub 2018 Jul 2. PMID: 30049384; PMCID: PMC6085585.
[31]Shao X, Sun S, Zhou Y, Wang H, Yu Y, Hu T, Yao Y, Zhou C. Bacteroides fragilis restricts colitis-associated cancer via negative regulation of the NLRP3 axis. Cancer Lett. 2021 Dec 28;523:170-181. doi: 10.1016/j.canlet.2021.10.002. Epub 2021 Oct 8. PMID: 34627951.[26]
[32]Vétizou M, Pitt JM, Daillère R, Lepage P, Waldschmitt N, Flament C, Rusakiewicz S, Routy B, Roberti MP, Duong CP, Poirier-Colame V, Roux A, Becharef S, Formenti S, Golden E, Cording S, Eberl G, Schlitzer A, Ginhoux F, Mani S, Yamazaki T, Jacquelot N, Enot DP, Bérard M, Nigou J, Opolon P, Eggermont A, Woerther PL, Chachaty E, Chaput N, Robert C, Mateus C, Kroemer G, Raoult D, Boneca IG, Carbonnel F, Chamaillard M, Zitvogel L. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science. 2015 Nov 27;350(6264):1079-84. doi: 10.1126/science.aad1329. Epub 2015 Nov 5. PMID: 26541610; PMCID: PMC4721659.
[33]大连图腾生物工程有限公司.图腾益生液抑制肿瘤作用实验报告[R].卫生部食品卫生监督检验所.1997-01-16.
[34]Zhang W, etl. Bacteroides fragilis Protects Against Antibiotic-Associated Diarrhea in Rats by Modulating Intestinal Defenses. Front Immunol. 2018 May 9;9:1040.
[35]Telesford KM, Yan W, Ochoa-Reparaz J, Pant A, Kircher C, Christy MA, Begum-Haque S, Kasper DL, Kasper LH. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39(+)Foxp3(+) T cells and Treg function. Gut Microbes. 2015 Jul 4;6(4):234-42. doi: 10.1080/19490976.2015.1056973. PMID: 26230152; PMCID: PMC4615798.
[36]Ochoa-Repáraz J, Mielcarz DW, Ditrio LE, Burroughs AR, Begum-Haque S, Dasgupta S, Kasper DL, Kasper LH. Central nervous system demyelinating disease protection by the human commensal Bacteroides fragilis depends on polysaccharide A expression. J Immunol. 2010 Oct 1;185(7):4101-8. doi: 10.4049/jimmunol.1001443. Epub 2010 Sep 3. PMID: 20817872.
[37]林楚慧,曾婷,吴倩仪,等.脆弱拟杆菌839治疗新诊断“可能的自身免疫相关癫痫”的疗效[J].癫痫杂志,2022,8(04):298-304.
[38]林楚慧,曾婷,邓宇虹,等.脆弱拟杆菌BF839治疗寻常型银屑病:一项单臂、开放初步临床试验[J].生物工程学报,2021,37(11):3828-3835.DOI:10.13345/j.cjb.210198.
[39]Li D, Pan Y, Xia X, Liang J, Liu F, Dou H, Hou Y. Bacteroides fragilis alleviates the symptoms of lupus nephritis via regulating CD1d and CD86 expressions in B cells. Eur J Pharmacol. 2020 Oct 5;884:173421.
[40]Zhou B, Dong C, Zhao B, Lin K, Tian Y, Zhang R, Zhu L, Xu H, Yang L. Bacteroides fragilis participates in the therapeutic effect of methotrexate on arthritis through metabolite regulation. Front Microbiol. 2022 Dec 15;13:1015130. doi: 10.3389/fmicb.2022.1015130. PMID: 36590441; PMCID: PMC9798205.
[41]Sofi MH, etc. A single strain of Bacteroides fragilis protects gut integrity and reduces GVHD. JCI Insight. 2021 Feb 8;6(3):e136841.
[41]Lin, C., Zeng, T. & Deng, Y. Improvement of epilepsy secondary to acquired immunodeficiency syndrome with intestinal microbiota preparations: a case report. Acta Epileptologica 6, 12 (2024). https://doi.org/10.1186/s42494-024-00156-5
[43]Johnson JL, Jones MB, Cobb BA. Bacterial capsular polysaccharide prevents the onset of asthma through T-cell activation. Glycobiology. 2015 Apr;25(4):368-75. doi: 10.1093/glycob/cwu117. Epub 2014 Oct 27. PMID: 25347992; PMCID: PMC4339875.
[44]Hu J, Chen J, Xu X, Hou Q, Ren J, Yan X. Gut microbiota-derived 3-phenylpropionic acid promotes intestinal epithelial barrier function via AhR signaling. Microbiome. 2023 May 8;11(1):102. doi: 10.1186/s40168-023-01551-9. Erratum in: Microbiome. 2023 May 20;11(1):113. doi: 10.1186/s40168-023-01576-0. PMID: 37158970; PMCID: PMC10165798.
[45]Geng Z, Wang X, Wu F, Cao Z, Liu J. Biointerface mineralization generates ultraresistant gut microbes as oral biotherapeutics. Sci Adv. 2023 Mar 15;9(11):eade0997. doi: 10.1126/sciadv.ade0997. Epub 2023 Mar 17. PMID: 36930714; PMCID: PMC10022893.
[46]Jenny L Johnson, Mark B Jones, Brian A Cobb, Polysaccharide-experienced effector T cells induce IL-10 in FoxP3 regulatory T cells to prevent pulmonary inflammation, Glycobiology, Volume 28, Issue 1, January 2018, Pages 50–58.
[47]Gautier T, Oliviero N, Ferron S, Le Pogam P, David-Le Gall S, Sauvager A, Leroyer P, Cannie I, Dion S, Sweidan A, Loréal O, Tomasi S, Bousarghin L. Bacteroides fragilis derived metabolites, identified by molecular networking, decrease Salmonella virulence in mice model. Front Microbiol. 2022 Nov 10;13:1023315. doi: 10.3389/fmicb.2022.1023315. PMID: 36466691; PMCID: PMC9710111.
[48]Li Z, Deng H, Zhou Y, Tan Y, Wang X, Han Y, Liu Y, Wang Y, Yang R, Bi Y, Zhi F. Bioluminescence Imaging to Track Bacteroides fragilis Inhibition of Vibrio parahaemolyticus Infection in Mice. Front Cell Infect Microbiol. 2017 May 11;7:170. doi: 10.3389/fcimb.2017.00170. PMID: 28553617; PMCID: PMC5425466.
[49]Tzianabos AO, Finberg RW, Wang Y, Chan M, Onderdonk AB, Jennings HJ, Kasper DL. T cells activated by zwitterionic molecules prevent abscesses induced by pathogenic bacteria. J Biol Chem. 2000 Mar 10;275(10):6733-40. doi: 10.1074/jbc.275.10.6733. PMID: 10702228.
[50]Pagliuca C, Cicatiello AG, Colicchio R, Greco A, Cerciello R, Auletta L, Albanese S, Scaglione E, Pagliarulo C, Pastore G, Mansueto G, Brunetti A, Avallone B, Salvatore P. Novel Approach for Evaluation of Bacteroides fragilis Protective Role against Bartonella henselae Liver Damage in Immunocompromised Murine Model. Front Microbiol. 2016 Nov 7;7:1750. doi: 10.3389/fmicb.2016.01750. PMID: 27872616; PMCID: PMC5097911.
[51]Mazmanian SK, Round JL, Kasper DL. A microbial symbiosis factor prevents intestinal inflammatory disease. Nature. 2008 May 29;453(7195):620-5. doi: 10.1038/nature07008. PMID: 18509436.
[52]Eribo OA, du Plessis N, Chegou NN. The Intestinal Commensal, Bacteroides fragilis, Modulates Host Responses to Viral Infection and Therapy: Lessons for Exploration during Mycobacterium tuberculosis Infection. Infect Immun. 2022 Jan 25;90(1):e0032121. doi: 10.1128/IAI.00321-21. Epub 2021 Oct 4. PMID: 34606367; PMCID: PMC8788684.
[53]Zhou W, etc. The gut microbe Bacteroides fragilis ameliorates renal fibrosis in mice. Nat Commun. 2022 Oct 14;13(1):6081.
[54]Yan X, Jin J, Su X, Yin X, Gao J, Wang X, Zhang S, Bu P, Wang M, Zhang Y, Wang Z, Zhang Q. Intestinal Flora Modulates Blood Pressure by Regulating the Synthesis of Intestinal-Derived Corticosterone in High Salt-Induced Hypertension. Circ Res. 2020 Mar 27;126(7):839-853. doi: 10.1161/CIRCRESAHA.119.316394. Epub 2020 Feb 13. PMID: 32078445.







